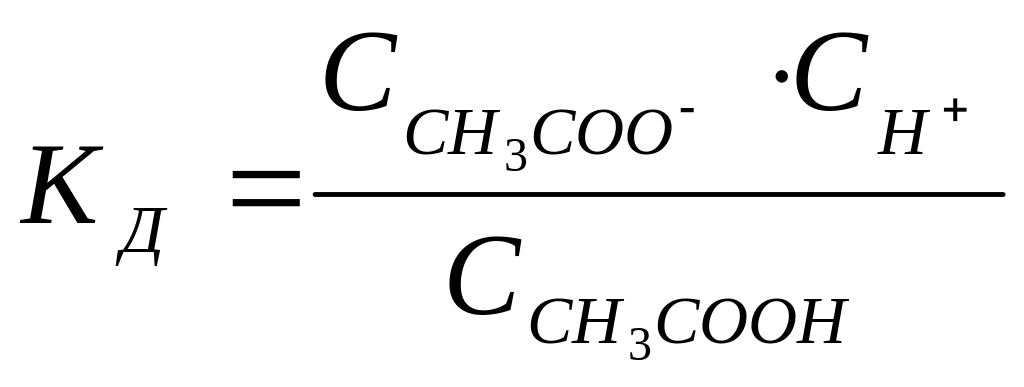
Закон разбавления Оствальда – это одно из важнейших понятий в химии, которое объясняет связь между концентрацией раствора и его оптической плотностью. Данный закон был открыт немецким химиком Фридрихом Оствальдом в 1901 году и описывает поведение сложных растворов, состоящих из нескольких взаимодействующих компонентов.
Суть закона Оствальда заключается в следующем: при разбавлении раствора его оптическая плотность уменьшается пропорционально числу молекул, находящихся в единице объема раствора. Формула закона выражается следующим образом: D = k * c, где D – оптическая плотность раствора, k – постоянная, зависящая от растворителя и длины волны, а c – концентрация раствора.
Закон Оствальда находит широкое применение в различных областях, особенно в физико-химических исследованиях и аналитической химии. Он позволяет определить концентрацию раствора по его оптической плотности и, наоборот, рассчитать оптическую плотность при заданной концентрации. Это является одним из основных методов определения концентрации веществ в растворах и находит применение в производстве лекарственных препаратов, анализе пищевых продуктов, изучении взаимодействия биологически активных веществ и др.
Основные принципы закона разбавления Оствальда
Первый принцип закона разбавления Оствальда заключается в том, что концентрация раствора обратно пропорциональна его объему. Это означает, что при увеличении объема раствора концентрация его компонентов уменьшается, а при уменьшении объема — увеличивается.
Второй принцип закона разбавления Оствальда указывает на то, что концентрация раствора обратно пропорциональна количеству растворимого вещества. То есть, при увеличении массы растворенного вещества концентрация его раствора увеличивается, а при уменьшении массы — уменьшается.
Третий принцип закона разбавления Оствальда связывает концентрацию и объем раствора с его плотностью. Плотность раствора обратно пропорциональна его объему, поэтому при увеличении объема плотность раствора уменьшается, а при уменьшении объема — увеличивается.
Оставальдовский закон разбавления широко применяется в химии и физике для решения различных задач. Например, по его формуле можно определить концентрацию раствора или массу растворенного вещества. Также этот закон позволяет провести расчеты для разведения растворов или получения их заданной концентрации.
Зачем нужен закон разбавления Оствальда?
Закон разбавления Оствальда представляет собой математическую формулу, которая позволяет определить скорость реакции на основе концентрации реагентов. Формула закона разбавления Оствальда выглядит следующим образом: скорость реакции = k * [A]^m * [B]^n, где k — константа скорости реакции, [A] и [B] — концентрации реагентов, m и n — степени реагентов в уравнении реакции.
Знание закона разбавления Оствальда является важным для понимания химических реакций и их скорости. Он позволяет определить, как изменение концентрации реагентов влияет на скорость реакции. Например, если концентрация одного из реагентов увеличивается, то скорость реакции, скорее всего, тоже увеличится. Это знание позволяет предсказать и контролировать химические процессы в промышленности и решать различные технологические задачи.
Кроме того, закон разбавления Оствальда позволяет выявить зависимость между скоростью реакции и концентрациями реагентов при различных условиях. Это важно для оптимизации реакционных условий и выбора оптимального реакционного средства.
Что такое закон разбавления Оствальда?
Согласно закону Оствальда, активность раствора пропорциональна его концентрации, при условии идеального разбавления. Это означает, что когда раствор разбавляется и его концентрация уменьшается, активность раствора также уменьшается. То есть, чем меньше концентрация раствора, тем меньше его активность.
Закон разбавления Оствальда имеет широкое применение в химии, биологии и фармацевтике. Он помогает определить активность раствора и предсказать его поведение при разбавлении или смешивании с другими растворами. Это особенно важно при проведении реакций, где необходимо учитывать концентрацию реагентов и тепловые эффекты.
Как применяется закон разбавления Оствальда?
Применение закона разбавления Оствальда особенно полезно при разведении растворов или при измерении концентрации определенных веществ в растворе. Для использования этого закона необходимо знать начальную концентрацию и объем раствора, а также желаемую концентрацию и объем разбавленного раствора.
Применение закона разбавления Оствальда очень простое. Используя данный закон, можно рассчитать объем разбавляемого раствора, зная начальную концентрацию и объем стартового раствора. Формула для расчета объема разбавляемого раствора выглядит следующим образом:
V2 = (V1 * C1) / C2
где V2 — объем разбавляемого раствора, V1 — объем стартового раствора, C1 — начальная концентрация раствора, C2 — желаемая концентрация раствора.
Применив данную формулу, можно точно рассчитать объем разбавляемого раствора для достижения желаемой концентрации. Этот принцип может быть полезным во многих лабораторных и промышленных процессах, где точное разбавление растворов является важной задачей.
Важно заметить, что закон разбавления Оствальда справедлив только при условии, что растворы полностью смешиваются и не происходят химические реакции между компонентами растворов.
Формула закона разбавления Оствальда
Формула закона разбавления Оствальда записывается следующим образом:
C1 * V1 = C2 * V2
где:
C1 — концентрация исходного раствора;
V1 — объем исходного раствора;
C2 — концентрация разбавленного раствора;
V2 — объем разбавленного раствора.
Формула закона разбавления Оствальда позволяет определить значения концентрации и объема раствора после его разбавления и является основой для решения множества задач в области химии и аналитической химии.
Как выглядит формула закона разбавления Оствальда?
C1 * V1 = C2 * V2
где:
- C1 — концентрация исходного раствора
- V1 — объем исходного раствора
- C2 — концентрация разбавителя
- V2 — объем разбавителя
Эта формула позволяет вычислить концентрацию итогового раствора при разбавлении исходного раствора разбавителем. Закон Оствальда имеет широкое применение в химических и биологических науках, а также в промышленности. Он позволяет проводить точные расчеты при различных разбавлениях растворов и использовать их в разных химических исследованиях и процессах.
Коэффициенты в формуле закона разбавления Оствальда
Оствальд предложил формулу, которая описывает зависимость между концентрацией раствора и его разбавлением. В этой формуле есть несколько коэффициентов, которые играют важную роль в вычислениях.
Первый коэффициент в формуле — это начальная концентрация раствора (C0). Он представляет собой концентрацию раствора до его разбавления.
Второй коэффициент — это объем разбавителя (V). Он указывает на количество разбавителя, которое добавляется к начальному раствору для получения нужной конечной концентрации.
Третий коэффициент — это конечная концентрация раствора (C). Он представляет собой концентрацию раствора после его разбавления.
Четвертый коэффициент — это коэффициент разбавления (D). Он определяется как отношение объема разбавителя к объему итогового раствора (D = V / V + V0), где V0 — объем начального раствора.
Пятый коэффициент — это коэффициент разбавления Оствальда (F). Он вычисляется по формуле F = C / C0.
Эти коэффициенты позволяют получить точные значения концентрации раствора после его разбавления с применением закона разбавления Оствальда.
Примеры расчетов по формуле закона разбавления Оствальда
Применение формулы закона разбавления Оствальда может быть полезно во многих областях, включая фармацевтику, пищевую промышленность и научные исследования. Разбавление растворов позволяет получить нужную концентрацию субстанции, что является важным шагом при подготовке растворов для проведения экспериментов и анализа.
Расчеты по формуле закона Оствальда осуществляются по следующей формуле:
C1V1 = C2V2
где С1 и С2 — концентрации исходного и разбавленного растворов соответственно, а V1 и V2 — объемы этих растворов.
Рассмотрим пример расчета:
Допустим, у нас есть 50 мл раствора с концентрацией 0.2 М. Необходимо разбавить этот раствор таким образом, чтобы получить раствор с концентрацией 0.1 М.
Для решения задачи мы используем формулу закона разбавления Оствальда:
C1V1 = C2V2
Подставляем известные значения:
0.2×50 = 0.1×V2
Делим обе части уравнения на 0.1:
10 = V2
Таким образом, чтобы получить раствор с концентрацией 0.1 М, необходимо взять 10 мл исходного раствора и разбавить его до объема 50 мл с помощью растворителя.
Таким образом, формула закона разбавления Оствальда предоставляет нам инструмент для расчета объема раствора, который необходимо взять и добавить к исходному раствору, чтобы получить желаемую концентрацию. Эта формула широко используется в лабораторной практике и научных исследованиях, что позволяет экономить время и ресурсы при подготовке растворов.
Вопрос-ответ:
Что такое закон разбавления Оствальда?
Закон разбавления Оствальда — это закон, который описывает зависимость между концентрацией раствора и показателем преломления этого раствора. Формула этого закона выглядит следующим образом: n = n0 + K * c, где n — показатель преломления раствора, n0 — показатель преломления чистого растворителя, K — коэффициент, зависящий от величины экстинкционного коэффициента, c — концентрация раствора.
Как применяется закон разбавления Оствальда в практике?
Закон разбавления Оствальда применяется во многих областях, таких как химия, физика, фармацевтика и другие. Он позволяет определять концентрацию раствора по измерению его показателя преломления. Это важно, например, при анализе препаратов в фармацевтической промышленности или при контроле качества пищевых продуктов.
Какая формула закона разбавления Оствальда?
Формула закона разбавления Оствальда выглядит следующим образом: n = n0 + K * c, где n — показатель преломления раствора, n0 — показатель преломления чистого растворителя, K — коэффициент, зависящий от величины экстинкционного коэффициента, c — концентрация раствора.
Как зависит показатель преломления от концентрации по закону Оствальда?
Показатель преломления раствора зависит от его концентрации по закону Оствальда: n = n0 + K * c, где n — показатель преломления раствора, n0 — показатель преломления чистого растворителя, K — коэффициент, зависящий от величины экстинкционного коэффициента, c — концентрация раствора. При увеличении концентрации раствора, его показатель преломления также увеличивается.
Как можно использовать закон разбавления Оствальда для определения концентрации раствора?
Закон разбавления Оствальда можно использовать для определения концентрации раствора, измеряя его показатель преломления. По измеренному значению показателя преломления и известным значениям показателя преломления чистого растворителя и коэффициента K можно рассчитать концентрацию раствора по формуле: c = (n — n0) / K.