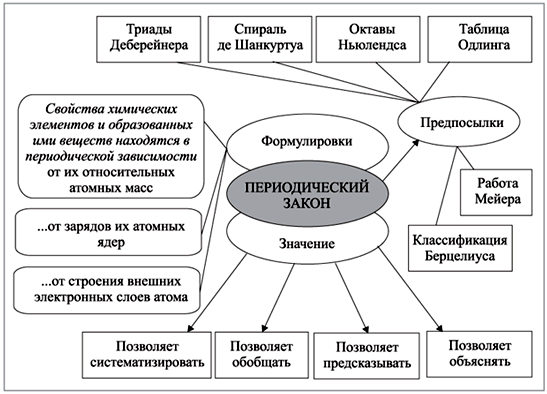
Периодический закон – один из фундаментальных законов химии, открывающий перед учеными мир элементов и их свойств. Этот закон устанавливает, что свойства элементов периодически повторяются при изменении их атомных номеров и строится на основе таблицы Менделеева.
Основное понятие, лежащее в основе периодического закона, – периодическая система химических элементов. В ней элементы расположены в порядке возрастания атомных номеров, при этом элементы с похожими свойствами располагаются в одной вертикальной группе. Каждая строка (период) таблицы соответствует новому энергетическому уровню электронной оболочки и может содержать элементы различных классов.
Согласно периодическому закону, основные свойства элементов периодически изменяются. Один из наиболее важных параметров – атомный радиус, который увеличивается по мере движения по периоду с левого к правому, а по вертикали в пределах одной группы увеличивается сверху вниз. Эти изменения в атомном радиусе определяют химические свойства элементов.
Понятия, свойства и законы периодического закона в 8 классе химии
Главное понятие периодического закона – химический элемент. Химический элемент – это вещество, состоящее из атомов с одинаковым атомным числом. Атомное число – это количество протонов в атоме элемента. Всего в периодической системе Менделеева насчитывается более 100 элементов.
Одним из ключевых свойств элементов, открытым благодаря периодическому закону, является их атомная масса. Атомная масса элемента – это сумма массы протонов и нейтронов, находящихся в ядре атома. Именно атомная масса и определяет положение элемента в периодической системе Менделеева.
С помощью периодического закона можно выявить и другие свойства элементов, такие как электроотрицательность, радиус атома, плотность и т. д. Расположение элементов в периодической системе позволяет предсказывать их свойства и химические реакции.
Одним из основных законов периодического элемента является закон Менделеева. Согласно этому закону, если элементы упорядочить по атомным массам, то их химические и физические свойства будут периодически повторяться. Это позволяет группировать элементы и создавать таблицу, известную как периодическая система Менделеева.
Периодический закон играет важную роль в химии, позволяя упорядочить и классифицировать элементы, а также предсказывать их свойства. Изучение периодического закона является важной частью учебной программы по химии в 8 классе.
История и описание периодического закона
Идея периодическости впервые была сформулирована в 1869 году российским химиком Дмитрием Менделеевым. Он создал таблицу, известную сейчас как Менделеевская таблица, в которой элементы были упорядочены по атомным номерам и их химическим свойствам. Менделеев предсказал существование ряда новых элементов и оставил пустые места в таблице, где они должны были быть расположены.
Периодический закон имеет несколько ключевых характеристик:
- Порядковый номер элемента в Менделеевской таблице соответствует его атомному номеру.
- На каждом периоде Менделеевской таблицы свойства элементов периодически меняются.
- Элементы, расположенные в одной группе Менделеевской таблицы, имеют схожие химические свойства.
Периодический закон имеет фундаментальное значение, так как он позволяет упорядочить и классифицировать химические элементы и предсказывать их свойства. Он является основой для дальнейшего изучения химии и развития научных открытий.
Развитие и открытие
Периодический закон развивался и открывался на протяжении многих лет благодаря работе множества ученых. Начиная с древних времен, люди старались понять природу веществ и их свойства.
В 17 веке английский алхимик Роберт Бойль провел ряд экспериментов с газами и сформулировал закон, который сейчас называется законом Бойля-Мариотта. Этот закон установил пропорциональность давления и объема газов.
В 18 веке французский химик Антуан Лавуазье провел исследования, которые привели к созданию закона сохранения массы. Он открыл, что за реакцией масса веществ не изменяется.
В 19 веке немецкий химик Иоганн Доберейнер открыл тренды в химических свойствах элементов и разработал первую классификацию элементов.
Затем русский ученый Дмитрий Иванович Менделеев разработал первую периодическую таблицу элементов в 1869 году. Он предсказал существование новых элементов, которые были открыты после его смерти.
В 20 веке были открыты новые элементы и уточнены многие свойства уже существующих элементов, что привело к современному представлению о периодическом законе.
С каждым открытием и развитием наука шагает вперед, расширяя нашу понимание мира и его строения.
| Ученый | Вклад |
|---|---|
| Роберт Бойль | Закон Бойля-Мариотта |
| Антуан Лавуазье | Закон сохранения массы |
| Иоганн Доберейнер | Тренды в химических свойствах элементов |
| Дмитрий Иванович Менделеев | Периодическая таблица элементов |
Определение и основные понятия
Периодический закон основан на понятии периодов и групп. Периоды — это горизонтальные строки таблицы Менделеева, которые отображают количество электронных оболочек у элементов. Группы — это вертикальные столбцы таблицы, которые объединяют элементы схожими химическими свойствами.
Периодический закон также включает понятие периодических свойств элементов. К ним относятся атомный радиус, ионизационная энергия, электроотрицательность и другие характеристики, которые изменяются по закономерному принципу с увеличением атомного номера.
Понимание периодического закона и его основных понятий является ключевым в химии, так как позволяет систематизировать знания о химических элементах и их свойствах.
Основные свойства элементов по периодическому закону
Согласно периодическому закону, элементы различаются по своим химическим и физическим свойствам. Однако, у них также есть некоторые общие особенности:
1. Атомный радиус: Атомный радиус элементов увеличивается при движении слева направо в периоде и уменьшается при движении сверху вниз в группе. Это связано с изменением количества энергетических уровней, на которых находятся электроны.
2. Электроотрицательность: Электроотрицательность характеризует способность элемента притягивать электроны к своему ядру. Ее значения увеличиваются справа налево в периоде и уменьшаются сверху вниз в группе. Наибольшую электроотрицательность имеют элементы в верхнем правом углу таблицы Менделеева.
3. Ионизационная энергия: Ионизационная энергия — это энергия, необходимая для удаления одного электрона из атома элемента. Она увеличивается справа налево в периоде и уменьшается сверху вниз в группе. Это связано с изменением силы притяжения между электронами и ядром атома.
4. Электронная конфигурация: Электронная конфигурация — это распределение электронов в энергетических уровнях атома элемента. Этот параметр определяет химические свойства элемента и его взаимодействие с другими веществами.
5. Окислительные свойства: Окислительные свойства элементов изменяются в зависимости от их положения в таблице Менделеева. Наиболее активные металлы находятся в верхней левой части таблицы, а наиболее активные неметаллы — в верхней правой части.
Эти основные свойства элементов по периодическому закону помогают понять и классифицировать химические элементы, а также предсказать их поведение и взаимодействие в различных химических реакциях.
Электронная конфигурация и расположение в таблице
В таблице Менделеева элементы располагаются в порядке возрастания атомного номера. Подобный порядок обусловлен увеличением количества электронов в атоме. Элементы располагаются в 7 периодах и 18 группах. Периоды обозначают горизонтальные строки таблицы, а группы — вертикальные столбцы.
Расположение элементов в таблице отражает особенности электронной конфигурации. В каждом периоде количество энергетических уровней увеличивается на единицу. При переходе от одной группы к другой, количество электронов в внешней оболочке (валентных электронов) меняется. В связи с этим элементы одной группы обладают схожими химическими свойствами.
Электроны в атоме располагаются на энергетических уровнях, которые обозначаются числами 1, 2, 3 и т. д. Сами электроны могут находиться на одном из подуровней – s, p, d, f. Каждый подуровень может содержать различное количество электронов. Уровень s может содержать максимум 2 электрона, уровень p – 6 электронов, уровень d – 10 электронов, а уровень f – 14 электронов.
Конфигурация электронов в атоме определяется заполняемыми подуровнями. Принцип Клейчера устанавливает порядок заполнения электронами подуровней следующим образом: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, и т.д. Подуровни заполняются в порядке возрастания числа энергии, а в случае его равенства – по возрастанию числа атомного номера.
С помощью электронной конфигурации можно объяснить множество химических свойств элементов и их взаимодействие. Она позволяет определить количество и расположение валентных электронов, которые определяют химическую активность атома. Также электронная конфигурация позволяет объяснить периодический закон и расположение элементов в таблице Менделеева.
Постоянные свойства: атомный радиус, электроотрицательность
В химии существуют несколько важных постоянных свойств элементов, которые определяются периодическим законом. Эти свойства помогают нам понять структуру и характеристики атомов и молекул.
Атомный радиус — это расстояние от центра атома до его внешней электронной оболочки. Он показывает размер атома и его способность вступать в химические реакции. Чем меньше атомный радиус, тем ближе электроны к ядру и тем сильнее притяжение между ними. В результате, атомы с меньшим атомным радиусом имеют большую электроотрицательность и склонность к притяжению электронов.
Электроотрицательность — это способность атома притягивать электроны внешней оболочки к себе. Она зависит от атомного радиуса и заряда ядра элемента. Чем больше электроотрицательность, тем сильнее атом притягивает электроны. Электроотрицательность играет важную роль в химических свойствах элементов и их способности образовывать связи с другими атомами. Например, элементы с высокой электроотрицательностью, такие как кислород или фтор, обладают большой способностью притягивать электроны и образовывать ковалентные связи с другими атомами.
Изучение атомного радиуса и электроотрицательности помогает нам понять характер химических связей, химические реакции и свойства элементов в периодической таблице. Эти постоянные свойства играют важную роль в понимании и объяснении химических процессов и явлений.
Периодичность химических свойств
Периодический закон химии устанавливает, что химические свойства элементов периодически повторяются при изменении их атомных номеров. Это означает, что элементы в таблице Mendeleev’a расположены таким образом, что их химические свойства периодически изменяются.
- Атомный радиус уменьшается при движении от левого к правому краю периодической таблицы. Это связано с увеличением заряда ядра и электронных оболочек, чем приводит к сильной электростатической силе притяжения между электронами и ядром.
- Электроотрицательность элементов также изменяется периодически. Она увеличивается при движении от левого к правому краю периодической таблицы, и уменьшается при движении от верхнего к нижнему краю. Это связано с изменением энергии электронных оболочек и способности элемента принимать и отдавать электроны.
- Частота и интенсивность реакций элементов также меняются периодически. Некоторые элементы легко вступают в химические реакции, тогда как другие реактивны только при определенных условиях. Это связано с энергией связи между атомами в молекулах и стабильностью образующихся соединений.
Понимание периодичности химических свойств элементов позволяет установить закономерности в их поведении и использовать эту информацию для прогнозирования свойств и реакций различных соединений.
Вопрос-ответ:
Что такое периодический закон?
Периодический закон — это закономерность, которая состоит в том, что химические и физические свойства элементов периодически меняются с увеличением их атомных номеров.
Какие свойства элементов меняются в периодической системе?
В периодической системе свойства элементов, такие как атомный радиус, электроотрицательность, ионизационная энергия, электронная конфигурация и химическая реактивность, меняются при переходе от одного элемента к другому.
Какие законы лежат в основе периодического закона?
В основе периодического закона лежат законы Менделеева и Мосли. Закон Менделеева заключается в том, что свойства элементов периодически повторяются при увеличении их атомных номеров. Закон Мосли утверждает, что свойства элементов изменяются в порядке возрастания их атомных номеров.
Каково значение периодического закона в химии?
Периодический закон имеет огромное значение в химии, так как он позволяет систематизировать знания о химических элементах и использовать их для предсказания свойств и реакций.
Какая периодичность наблюдается в свойствах элементов в периодической системе?
В периодической системе элементов наблюдается периодичность в свойствах, что означает, что некоторые свойства элементов периодически повторяются, например, ионизационная энергия увеличивается по мере перехода от одного элемента к другому.