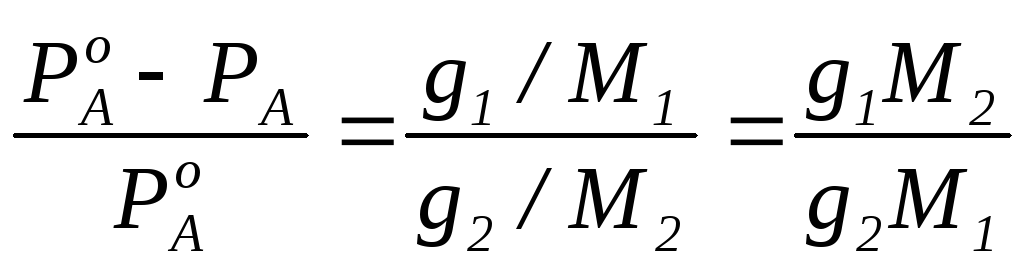
Формула закона Рауля – одно из важнейших понятий в физике и химии. Она была разработана французским физиком и химиком Андре-Луи Раулем и позволяет определить парциальное давление компонента смеси газов при заданных условиях.
В основе формулы лежит закон Рауля, утверждающий, что парциальное давление каждого отдельного компонента в смеси прямо пропорционально его молярной доле и общему давлению смеси. Другими словами, формула закона Рауля позволяет расчетно установить долю каждого газа в смеси и прогнозировать его поведение и свойства при определенных условиях.
Формула закона Рауля имеет следующий вид: P = X * P0, где P – парциальное давление компонента в смеси, X – молярная доля данного компонента в смеси, P0 – общее давление смеси. С помощью этой формулы можно определить парциальное давление каждого газа в смеси и его влияние на свойства и поведение смеси в целом.
Формула закона Рауля находит широкое применение в химической промышленности, физике, газовой динамике, биологических исследованиях и других отраслях науки и техники. С ее помощью можно прогнозировать поведение различных газовых смесей, определять их свойства и осуществлять контроль качества в процессе производства.
Формула Рауля
Формула выражается следующим образом:
PA = XA * PA^*
где:
PA — парциальное давление компонента A в идеальном растворе
XA — мольная доля компонента A в идеальном растворе
PA^* — парциальное давление чистого компонента A
Формула Рауля применяется в химической термодинамике и физической химии для описания поведения растворов. Она позволяет определить парциальное давление компонента в идеальном растворе на основе его мольной доли и парциального давления в чистом состоянии.
Применение формулы Рауля позволяет рассчитать физические свойства растворов, такие как температура кипения, концентрация раствора и давление.
Формула Рауля является важным инструментом для изучения коллективных эффектов в растворах и находит широкое применение в различных областях, включая химическую промышленность, фармацевтику и пищевую промышленность.
Описание
Согласно закону Рауля, парциальное давление идеального растворителя в растворе пропорционально его молярной концентрации и температуре. Формулу закона Рауля можно записать следующим образом:
| давление раствора | = | парциальное давление идеального растворителя в чистом состоянии | + | парциальное давление растворяемого вещества |
| Pраствор | = | Pрастворителя | + | Pрастворяемого |
Где Pраствор — давление раствора, Pрастворителя — парциальное давление идеального растворителя в чистом состоянии, Pрастворяемого — парциальное давление растворяемого вещества.
Закон Рауля является одним из базовых законов химической термодинамики и находит применение во многих областях, таких как химия растворов, физическая химия, биохимия, фармацевтическая промышленность и других.
Что такое формула Рауля?
Формула Рауля применяется в физической и химической термодинамике для описания поведения и свойств растворов.
Согласно формуле Рауля, температура кипения раствора ниже температуры кипения чистого растворителя. Изменение температуры кипения зависит от концентрации раствора и эффективного давления над раствором.
Формула Рауля имеет вид:
Pраств = Xраств * P0,
где Pраств — парциальное давление растворенного вещества, Xраств — его молярная доля в растворе, P0 — давление чистого растворителя при данной температуре.
Формула Рауля позволяет вычислить парциальное давление растворенного вещества и, таким образом, предсказать изменение кипящей температуры раствора.
Происхождение формулы
Формула закона Рауля была разработана французским химиком и физиком Франсуа Мари Шарлем Роланом Раулем в 1834 году. На основе его экспериментальных исследований о паровых давлениях и учете коллективного движения молекул, Рауль сформулировал закон, описывающий связь между паровым давлением и концентрацией раствора.
Формула закона Рауля выражает зависимость парового давления раствора от доли молярной концентрации растворенного вещества в растворе. Она имеет вид:
| P | = | X | Po |
где P — паровое давление раствора, X — доля молярной концентрации растворенного вещества, Po — паровое давление чистого растворителя.
Формула закона Рауля позволяет предсказывать паровые давления растворов на основе их концентрации, что имеет практическое применение в химической и фармацевтической промышленности. Она также служит основой для понимания процессов, связанных с фазовыми равновесиями в системах с растворами.
Математическое представление
Формула закона Рауля математически описывает изменение парциального давления компонента i в идеальном газовом растворе при добавлении других компонентов:
Пi = xi * P
Где:
- Пi — парциальное давление компонента i;
- xi — мольная доля компонента i в смеси;
- P — общее давление в системе.
Таким образом, формула позволяет вычислить парциальное давление компонента i в идеальном газовом растворе, исходя из его мольной доли в смеси и общего давления.
Закон Рауля является одним из основных законов, используемых в химии и физике для описания поведения растворов и газовых смесей. Он находит применение в таких областях, как физическая химия, физиология, биология, инженерия и других.
Применение
Формула закона Рауля имеет широкое применение в физике и химии. Она позволяет оценить изменение температуры, давления и объема вещества при изменении количества вещества или изменении внешних условий.
В физике формула закона Рауля играет важную роль при изучении фазовых переходов, таких как кипение или кристаллизация. С ее помощью можно предсказать поведение и свойства смесей газов и жидкостей при различных температурах и давлениях.
В химии закон Рауля используется для оценки парциальных давлений компонентов в идеальных растворах и растворах с низкой ассоциацией. Он помогает определить концентрацию компонентов в растворе и предсказать их поведение при смешении или разбавлении.
Также формула закона Рауля находит применение в технических и промышленных процессах, например при производстве лекарств, напитков или химических реакциях. Она позволяет контролировать и оптимизировать условия процессов, учитывающие влияние парциального давления веществ на их свойства и реакции.
Важно отметить, что формула закона Рауля применима только для идеальных газов и идеальных растворов, где не происходит взаимодействие между молекулами компонентов.
Формула Рауля в химии
Согласно формуле Рауля, парциальное давление компонента в идеальном растворе равно произведению мольной доли данного компонента на его парциальное давление в чистом состоянии:
pкомп = xкомп * pчистого вещества
Где:
- pкомп — парциальное давление компонента в идеальном растворе;
- xкомп — мольная доля компонента в идеальном растворе;
- pчистого вещества — парциальное давление чистого вещества.
Формула Рауля позволяет оценить изменение парциального давления компонента при его растворении. Используя эти данные, можно анализировать свойства и поведение растворов, таких как температурная зависимость давления, изменение состава раствора при добавлении компонентов и другие физико-химические процессы.
Формула Рауля также является основой для других законов и моделей, применяемых в химии и химической технологии. Она используется для расчета фазовых равновесий, давления пара и растворимости компонентов.
Формула Рауля в физике
Согласно формуле Рауля, парциальное давление идеального раствора двух жидкостей, представленных компонентами A и B, можно определить через их мольные доли и парциальные давления в чистом состоянии:
| Компонент | Мольная доля | Парциальное давление |
|---|---|---|
| A | xA | PA |
| B | xB | PB |
Формула Рауля выражается следующим образом:
P = xA*PA + xB*PB
где P — парциальное давление идеального раствора, xA и xB — мольные доли компонентов A и B соответственно, PA и PB — парциальные давления компонентов A и B в чистом состоянии.
Формула Рауля находит применение в различных областях физики и химии, а также в технологии производства растворов, например, в фармацевтической и пищевой промышленности. Она позволяет предсказать парциальное давление компонентов в идеальном растворе на основе их мольных долей и парциальных давлений в чистом состоянии, что позволяет более точно контролировать процессы смешения и разделения веществ.
Вопрос-ответ:
Что такое формула закона Рауля?
Формула закона Рауля описывает изменение парциального давления компонента в идеальном растворе при добавлении растворителя.
Каким образом можно применить формулу закона Рауля?
Формула закона Рауля может быть использована для расчета парциального давления компонента в идеальном растворе при изменении количества растворителя.
Какими параметрами характеризуется формула закона Рауля?
Формула закона Рауля зависит от мольной доли компонента в растворе и парциального давления этого компонента в чистом состоянии.
Какую роль играет формула закона Рауля в химии?
Формула закона Рауля является основой для понимания и описания изменения параметров растворов, таких как парциальное давление, при добавлении растворителя.
Какова основная идея формулы закона Рауля?
Основная идея формулы закона Рауля заключается в показе, что при добавлении растворителя в раствор, парциальное давление компонента в растворе снижается пропорционально доле растворителя.